18 Settembre 2024 ![]()
Di Barbara Illi e Patrizia Lavia, Istituto di Biologia e Patologia Molecolari, CNR
Il nuovo vaccino di Novavax, Nuvaxovid/NVX-CoV2373, nel ventaglio dei vaccini disponibili
Lo scorso 15 dicembre l’Organizzazione Mondiale della Sanità ha autorizzato il nuovo vaccino Nuvaxovid o NVX-CoV2373, un potenziale nuovo strumento nella lotta contro l’epidemia di Sars-CoV-2, approvato in Italia il 22 dicembre dall’AIFA. Il vaccino, sviluppato dalla Novavax, una piccola e coraggiosamente perseverante biotech nel Maryland (USA), ha una concezione diversa dai vaccini attualmente in uso, basata sulla composizione solo proteica; vaccini con questa composizione sono usati da circa un secolo per prevenire un’ampia serie di patologie. Pertanto, il nuovo vaccino rappresenta una nuova arma sotto un duplice aspetto: amplia il ventaglio di vaccini disponibili e, avendo una composizione sperimentata da lungo tempo, potrebbe rassicurare coloro che sono esitanti nei riguardi dei nuovi vaccini. Inoltre, ha costi di produzione più bassi, non deve rispettare una catena del freddo stringente, ed è facile da distribuire anche in paesi dove le infrastrutture sanitarie sono deboli. Sono dunque molte le speranze che esso possa contribuire alla lotta contro il SARS-CoV-2, sia superando le resistenze nella popolazione scettica dei vaccini, che aumentando il tasso di vaccinazione nel mondo, in un momento in cui assistiamo all’emergenza di nuove varianti che si trasmettono così facilmente da aspettarci nuovi focolai.
In un precedente articolo abbiamo schematizzato i diversi tipi di vaccini attualmente disponibili contro Sars-CoV-2 (CoV-2). Qui ricordiamo brevemente che tutti utilizzano come immunogeno la proteina Spike, grazie alla quale CoV-2 infetta le cellule del nostro epitelio respiratorio; i diversi vaccini si diversificano poi per le strategie molecolari con cui la Spike viene fornita al sistema immunitario:
- sotto forma di RNA (Pfizer/BioNTech e Moderna);
- sotto forma di DNA in vettori adenovirali (AstraZeneca, Johnson & Johnson ed anche il russo Sputnik, che non ha chiesto l’autorizzazione in UE ma è largamente usato altrove);
- direttamente sotto forma di proteina, come nel caso, appunto, dell’ultimo arrivato Novavax.
Tra i vaccini proteici, menzioniamo anche il cubano Soberana, costituito da subunità della proteina Spike glicosilate. Soberana si sta rivelando si sta rivelando efficace nell’abbattere il contagio a Cuba, come ha riportato Nature. Poiché Nuvaxovid sarà presto disponibile in Italia, in questo articolo cerchiamo di capire in che cosa sia diverso dagli altri e perché può essere più rassicurante per una parte dei cittadini.
La “vaccine hesitancy” e i timori rispetto ai vaccini a DNA, e RNA
In primo luogo occorre capire le diffidenze di chi non si vaccina, non tanto per ideologia, quanto per paura, sentimento umano di cui bisogna prendere atto per riuscire a gestirlo.
Dopo un anno di vaccinazioni, pur senza addentrarci in un’approfondita disamina dei vantaggi e limiti dei diversi vaccini, possiamo fare alcune considerazioni. Occorre riconoscere che nel primo anno dell’esplosione di CoV-2 ci sono stati errori di comunicazione. Ad esempio, non è stato sufficientemente spiegato che i vaccini non possono abbattere la trasmissione di un’infezione, soprattutto se trasmessa per via respiratoria, laddove non si applichino anche misure di contenimento (mascherine, distanziamento) e si continui a “respirare” virus, creando delusione in alcuni (“allora i vaccini non servono”).
Tuttavia, se è vero che i vaccini non rendono immuni, e dunque ci si può contagiare da vaccinati, gli anticorpi che essi inducono limitano molto la durata dell’infezione. Questo è fondamentale sia per la salute dell’individuo, nel quale gli anticorpi prevengono la malattia severa, sia per l’evoluzione della pandemia, poiché gli anticorpi riducono il tempo in cui il virus può replicare ed eventualmente sviluppare e fissare mutazioni. Infatti, tutte le varianti che hanno causato le diverse “ondate” (prima delta, ora omicron, sempre più affini al nostro recettore ACE-2 sulle cellule dell’epitelio respiratorio, il “ponte levatoio” per il virus) sono emerse in popolazioni con copertura vaccinale bassa. Tutti i vaccini, in presenza di nuove ondate, riducono la sintomatologia, le ospedalizzazioni e i decessi. Tuttavia molte persone fanno resistenza e molte sono stanche.
Allarme hanno destato i vaccini a vettore adenovirale a DNA, in particolare Astra Zeneca, nonostante prevenga efficacemente la malattia Covid-19 severa. Ma l’incidenza pur molto bassa di casi avversi, soprattutto trombotici, ha avuto l’effetto di uno shock inatteso. La tendenza ad aggregare proteine responsabili dei fenomeni trombotici è una rara conseguenza avversa dei vettori adenovirali. Il vaccino Astra Zeneca ha mostrato un ulteriore limite nell’indurre anticorpi che “non vedono” alcune varianti (per esempio beta e l’attuale omicron, che mantiene alcune mutazioni in comune con beta). Per queste ragioni la fornitura di Astra Zeneca è stata dismessa in diversi paesi, tra cui il Sud Africa e i paesi UE. Le iniziali “grandi promesse” seguite poi da repentini dietrofront, a volte comunicati in modo confuso o contraddittorio, hanno alimentato incertezze.
Il vaccino Johnson & Johnson, pure a base adenovirale, ha efficacia poco inferiore rispetto ad Astra Zeneca, ma raggiunta in una sola iniezione – quindi adatto a chi, per varie ragioni, non può sopportare una doppia dose. Ha anch’esso presentato rarissimi effetti collaterali trombotici come Astra Zeneca, soprattutto negli USA, dove è stato molto utilizzato. In Italia è stato complessivamente usato meno.
I vaccini Pfizer/BioNTech e Moderna, più innovativi dal punto di vista biotecnologico, non fanno uso di un adenovirus come “veicolo” ma usano direttamente l’RNA di Spike, che fornisce le istruzioni per la sintesi della proteina nelle nostre cellule. Hanno dimostrato grande efficacia, con frequenza di casi avversi trascurabile e induzione di anticorpi con riconoscimento più ampio e duraturo. Ma questi vaccini hanno suscitato resistenze in alcuni proprio a causa della loro innovazione. Di queste resistenze, collettivamente definite “vaccine hesitancy”, o esitazione vaccinale, che non vanno derise né liquidate con sufficienza, si è occupata la rivista Nature Medicine. Anche l’Istituto Superiore di Sanità ha dedicato una sezione del suo sito.
Vediamo allora le paure più comuni a cui Novavax potrebbe rispondere.
Alcuni definiscono – erroneamente – i nuovi vaccini “genici”, parola che suscita in alcuni la visione di terrificanti trasformazioni e alterazioni dell’organismo, temute come minaccia alla nostra integrità. Anche alcuni gruppi religiosi convergono sullo stesso tipo di obiezione. I vaccini ad RNA non sono genici (cioè attinenti ai geni), ma purtroppo la definizione, errata, è stata usata anche da figure con ruoli professionali importanti e “televisivamente” molto visibili. I vaccini sono al contrario ingegnerizzati per eliminare la possibilità che si integrino nel nostro genoma.
Altre paure più confuse sono riassunte nello slogan “non si sa cosa c’è dentro”. Naturalmente, per tutti i vaccini, come per tutti i farmaci, la composizione è depositata. Queste paure sono il risultato di scarsa o nessuna conoscenza informata e sono in fondo le più facili da discutere, a patto che non sconfinino nel complottismo.
Paure più elaborate si basano sul timore che i vaccini siano stati testati troppo in fretta e non abbiano avuto i dovuti controlli. In realtà, la ricerca sui farmaci e vaccini a RNA ha almeno 30 anni di storia (quella a DNA è ancora più antica). Quando, a gennaio 2020, i ricercatori di Wuhan hanno resa nota la sequenza del genoma di CoV-2, è stato sufficiente adattare alla sequenza di Spike metodiche che erano già ampiamente sviluppate. Le approvazioni sono state rapide perché si è concordato di svolgere le fasi 1, 2 e 3 contemporaneamente, in modo parzialmente sovrapposto, anzichè una dopo l’altra. Ma non sono mancati i controlli ad ogni fase, e tutti i trial presentati per l’approvazione avevano arruolato decine di migliaia (almeno 40.000) di soggetti. Tutti i vaccini, compreso il controverso Astra Zeneca, hanno dimostrato buona tollerabilità, e – spiace dirlo, ma è così – i casi avversi sono occorsi in proporzioni per così dire attese.
Tuttavia, è vero che vaccini di questo tipo non erano stati usati prima della pandemia di CoV-2. L’8 dicembre 2021 ha segnato il primo anniversario dei vaccini contro CoV-2, il vaccino Pfizer somministrato a Sandra Lindsay, 91 anni (qui la sua bella intervista alla BBC in occasione dell’anniversario). 3,7 miliardi di persone nel mondo, di tutte le etnie, sesso ed età, sono state vaccinate con doppia dose, alcuni appunto da un anno, con frequenza davvero bassa di casi avversi e con enorme riduzione delle morti da Covid-19 rispetto alle morti pre-vaccino del 2020. È quindi indubbio che i benefici dimostrati superino di gran lunga i rischi ipotetici.
Il fatto che lo stesso pubblico non questioni invece la composizione di un farmaco che venga loro prescritto per la prima volta, né pretenda di sapere quanti e quali controlli quel farmaco abbia superato, dimostra che la vaccine hesitancy esprime paure profonde che possono essere difficili da contrastare con argomenti razionali. Secondo un’inchiesta della rivista Forbes, la rapida diffusione della variante delta negli Stati Uniti può essere attribuita, in larga parte, proprio ad una esitazione vaccinale definita “irragionevole e ostinata” da parte di individui che hanno costituito dei serbatoi favorevoli alla replicazione di questa variante.
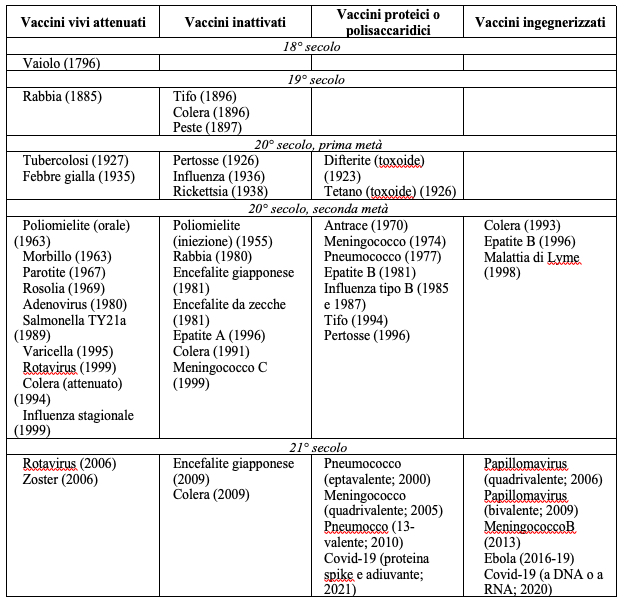
Il vaccino ideato da Novavax, basato sulla proteina Spike, potrebbe far cadere i timori sul potere ignoto e “trasformante” del DNA o dell’RNA. Come si vede in Tabella, i vaccini proteici, elencati in Colonna 3, risalgono agli anni ’20 del ‘900 ed hanno ormai un secolo di storia. La loro tollerabilità ed efficacia è consolidata da decenni. Ad esempio, il vaccino contro l’epatite B, del 1986, raccomandato negli USA per i neonati nel primo giorno di vita, è a subunità proteica.
La genesi del vaccino di Novavax
La storia del vaccino Nuvaxovid contro SARS-CoV-2 è una storia di perseveranza e di rivincita. Novavax è una piccola biotech del Maryland dedicata allo sviluppo di vaccini, che 20 mesi fa ha dovuto fare fronte al rischio di chiusura. I ricercatori avevano sviluppato una tecnica per produrre vaccini a subunità proteiche legate ad un adiuvante per aumentare la forza della reazione immunitaria. Avevano prodotto un promettente vaccino contro l’influenza studiato per pazienti anziani, che però non aveva ancora terminato il trial; avevano anche creato vaccini contro due coronavirus “parenti” del CoV-2, rispettivamente causa della SARS e della MERS, ma nessuno dei due era arrivato al mercato. Novavax non era quindi considerata una company di successo dal punto di vista commerciale.Declassata dal NASDAQ, aveva visto il valore delle sue azioni crollare a meno di 1 dollaro. Per far fronte, la company aveva dovuto vendere due delle sue sedi di produzione e dimezzare il suo personale, ma i suoi ricercatori avevano accumulato una notevole esperienza.
Dopo la pubblicazione della sequenza del genoma di CoV-2 nel gennaio del 2020, Gregory Glenn, direttore del settore ricerca e sviluppo di Novavax, programma immediatamente la sintesi del gene per la proteina Spike. Il 3 Febbraio il gene è pronto: i ricercatori eseguono una serie di prove dalle quali ottengono una proteina stabile, con una conformazione simile allo stato che assume la Spike di CoV-2 immediatamente prima di fondersi alla membrana plasmatica della cellula bersaglio e dunque potenzialmente in grado di indurre una risposta anticorpale.
In marzo, la squadra diretta da Nita Patel, straordinaria biotecnologa di origine indiana (ne abbiamo ricordato la storia qui) conferma in test di laboratorio che la proteina lega in modo molto forte il recettore ACE2 sulle cellule umane. I risultati fanno sperare che gli anticorpi indotti dalla Spike di Novavax possano interferire con la Spike del virus nel momento in cui questo si prepara a fondersi alle cellule umane. Novavax contatta allora il gruppo di biologia strutturale diretto da Andrew Ward all’Istituto Scripps di San Diego e chiede loro di verificare la struttura e la stabilità della proteina. La risoluzione al microscopio elettronico dimostra che la Spike di Novavax è effettivamente stabile ed ha una struttura in grado di suscitare una vigorosa risposta anticorpale. Altre prove dimostrano che la proteina rimane stabile per molte settimane a temperature tra i 2°C e gli 8°C: un vantaggio enorme rispetto ai vaccini Moderna e Pfizer, che devono essere conservati a temperature molto basse.
Inattesi alleati: le falene
Nello sviluppo di un vaccino proteico la sfida è produrre la proteina in quantità significative senza alterarne la struttura. Novavax aveva messo a punto un sistema ingegnoso per questo, inventato già nel 1983 da Gale Smith, uno dei ricercatori a capo dello sviluppo dei vaccini, con altri colleghi, grazie ad un alleato insospettato: le falene! Il sistema utilizza un virus a DNA che infetta gli insetti, il baculovirus, in grado di “trasportare” pezzi di DNA di origine estranea, anche di grandi dimensioni. Smith e colleghi avevano inserito in baculovirus il gene umano per l’interferone e lo avevano usato per infettare cellule di falena, traferendo in esse il gene umano. Le cellule di falena infettate si erano rivelate capaci di produrre interferone umano. Il sistema non fu però capito in tutta la sua potenzialità e, dopo diversi tentativi travagliati, fu pubblicato in una rivista di medio livello.
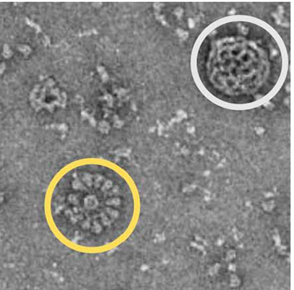
Il procedimento per produrre la Spike di CoV-2 è schematizzato in Figura 1: il gene per Spike viene introdotto in baculovirus; il baculovirus ricombinante è usato per infettare le cellule di falena e viene lasciato replicare. Le cellule di falena, come già visto nel caso dell’interferone, esprimono efficacemente Spike sulla membrana plasmatica. Le proteine Spike vengono quindi isolate ed incubate con un veicolo che ne agevola la somministrazione: si tratta di particelle sintetiche, di per sé non immunogeniche, di circa 30 nanometri di diametro. Ognuna di queste nanoparticelle – viste le dimensioni – può accomodare 14 unità di Spike: come si vede in Figura 1, la particella finita ha una struttura che somiglia a quella del coronavirus, appena un po’ più piccola.
Novavax aggiunge un adiuvante di origine naturale sviluppato da loro in grado di stimolare la risposta del sistema immunitario, la Matrix-M: questa non è altro che la saponina, una molecola glicosidica presente in diverse piante usate come piante officinali. Matrix-M, oltre a stimolare la risposta immunitaria, conferisce alle particelle una struttura ordinata a celle di alveare di 40 nanometri.
Gli ingredienti di base del vaccino, chiamato Nuvaxovid o NVX-CoV2373, sono quindi soltanto unità di proteina Spike, organizzate in modo da “simulare” la struttura del Cov-2, unite a un adiuvante naturale. È con questa composizione che si spera di abbattere almeno una parte delle resistenze antivaccino.
Chi la dura la vince, ma occorrono decisioni rapide
Come abbiamo visto, lo sviluppo dei vaccini proteici richiede che l’immunogeno, in questo caso la Spike, riproduca in modo fedele la Spike naturale del virus e sia sufficientemente stabile da mantenere il potenziale immunogenico nelle fasi di produzione, confezionamento e distribuzione. Inoltre i vaccini proteici hanno bisogno di un adiuvante per stimolare una forte risposta immune, in questo caso la saponina Matrix-M. Questi step non sono necessari quando si inietta DNA, come nel caso dei vaccini adenovirali, o RNA, come nel caso di Moderna e Pfizer, dove la proteina Spike è prodotta dal soggetto vaccinato stesso. I vaccini proteici hanno quindi uno sviluppo più lungo e più lento rispetto a quelli basati sugli acidi nucleici.
Per Novavax sarebbe stato impossibile velocizzare la produzione, visto anche il ridimensionamento subito. Ma il 24 Marzo arriva la buona notizia: il vaccino anti-influenzale diretto agli anziani – prodotto anch’esso sfruttando il sistema delle cellule di falena – ottiene buoni risultati alla conclusione del trial di fase 3. L’affermazione della capacità di Novavax giunge quindi, in modo fortuito, in un momento cruciale per il destino del vaccino contro CoV-2. Di lì a tre giorni, si svolge una conferenza Zoom cruciale tra i ricercatori Novavax e l’organizzazione internazionale non-profit CEPI, la Coalizione per l’Innovazione nella Preparazione alle Epidemie. CEPI è uno dei partner principali dell’iniziativa Covax sostenuta dall’OMS per la distribuzione dei vaccini nel mondo, in particolare nei paesi a basso reddito. I ricercatori Novavax possono trasmettere nella conferenza le immagini prodotte a San Diego dal gruppo di Ward, che mostrano le nanoparticelle costellate di proteine Spike con molecole di saponina disposte intorno a formare una sorta di struttura ad alveare (Figura 2). Dopo 6 settimane, la CEPI delibera un finanziamento di 384 milioni di dollari. Ai primi di luglio, anche il governo americano, con l’Operation Warp Speed, lanciata con l’obiettivo di produrre milioni di dosi di vaccino in tempi brevi, assegna a Novavax un ulteriore finanziamento di 1,6 miliardi di dollari, di cui 800 milioni erogati immediatamente. Novavax è la più piccola tra le 7 aziende farmaceutiche che hanno ottenuto i fondi stanziati per Warp Speed.
A maggio 2020 Novavax lancia il trial di fase 1 per saggiare la tollerabilità del vaccino in 131 soggetti arruolati in Australia. Con i finanziamenti ricevuti, acquista, per 167 milioni di dollari, un impianto di produzione di ottimo livello nella Repubblica Ceca, in grado di produrre diversi milioni di dosi. In agosto, la piccola company ottiene una prima rivincita, annunciando ottimi risultati dal trial Australiano: dopo due iniezioni, la risposta anticorpale si dimostra più efficace rispetto a quella ottenuta da altri vaccini noti, senza eventi avversi. I ricercatori dimostrano inoltre che, in scimmie immunizzate con diverse dosi di vaccino e poi infettate con CoV-2, il virus non riesce a moltiplicarsi nelle vie aree superiori; si replica nei polmoni di un solo animale che aveva ricevuto la dose più bassa e quell’animale elimina l’infezione in 4 giorni. Angela Rasmussen, virologa della Columbia University, dice: “è l’unico vaccino che ho visto capace di bloccare la replicazione virale già nei tamponi nasali degli animali vaccinati. Questo è molto importante, perchè bloccare la replicazione virale nel naso può ridurre il contagio tra persone che possono non sapere di essere contagiate.”
L’efficacia di Nuvaxovid / NVX-CoV2373
A fine settembre 2020, quando Moderna, Pfizer, Johnson & Johnson ed AstraZeneca sono già in fase III molto avanzata, Novavax lancia i suoi trial clinici di fase 3. I dati ottenuti da due studi, pubblicati entrambi sul New England Journal of Medicine, hanno mostrato un’efficacia molto elevata del Nuvaxovid nel prevenire la malattia sintomatica, sia lieve/moderata che grave.
Il primo studio, effettuato nel Regno Unito e pubblicato a settembre 2021, ha arruolato 14.039 individui dai 18 agli 84 anni, di cui circa il 28% aveva più di 65 anni e il 44, 6% con patologie preesistenti. Nel gruppo di vaccinati si sono verificate 10 infezioni su 7000 individui, contro le 96 del gruppo di controllo (costituito dai restanti 7000 volontari), attestando un’efficacia del vaccino nel prevenire la malattia sintomatica moderata/severa – al 7° giorno dall’inoculazione della seconda dose – dell’89,7%. In questo studio si sono verificati 5 casi di malattia severa, tutti nel gruppo placebo.
Il secondo studio, effettuato negli USA e in Messico secondo gli stessi criteri e pubblicato il 15 novembre scorso, ha visto la partecipazione di 29.582 persone dai 18 anni in su, alcuni affetti da patologie croniche ma clinicamente stabili (diabete di tipo 2, malattie cardiovascolari, renali e dell’albero respiratorio). I risultati sono essenzialmente sovrapponibili allo studio precedente, con 10 infezioni da SARS-CoV-2 tra i vaccinati (19.714 individui) contro 63 del gruppo placebo (9868 individui), indicando un’efficacia del vaccino nella protezione della malattia sintomatica moderata/severa del 90,4%. Anche in questo caso sono stati registrati 10 casi di malattia moderata e 4 di malattia severa solo nel gruppo placebo, attestando un’efficacia del vaccino del 100% contro la malattia medio/grave.
Bisogna sottolineare che queste sperimentazioni si sono concluse prima dell’emergenza delle varianti delta e omicron. In particolare, lo studio degli Stati Uniti e Messico è stato condotto quando le varianti prevalenti in quelle aree geografiche erano alfa, beta, gamma, iota ed epsilon.
Sulla base dei dati ottenuti, il 15 novembre Novavax ha sottomesso la domanda per l’approvazione del suo vaccino all’FDA statunitense. 2 giorni dopo, ha ricevuto dall’Organizzazione Mondiale della Sanità e dalle agenzie regolatorie di Indonesia, subito seguita dalle Filippine, l’approvazione ad uso di emergenza. [1] Il 20 dicembre l’EMA ha concesso a Nuvaxovid un’approvazione condizionale all’immissione in commercio.
La prima approvazione di novembre ha aperto la strada non solo per l’approvazione in altri paesi, ma soprattutto apre una grande speranza per quanto riguarda la distribuzione del vaccino attraverso il programma Covax, l’iniziativa sostenuta dalle Nazioni Unite per la condivisione dei vaccini al livello mondiale. Per questo obiettivo, che prevede la distribuzione di alcuni miliardi di dosi, occorre una produzione su larga scala, che eccede le capacità produttiva di Novavax. Il 28 dicembre è stato quindi siglato un accordo in base al quale il vaccino sarà prodotto dal Serum Institute of India, l’Istituto cha ha la maggiore capacità, in termini di volume, di produzione di vaccini al mondo (.). La decisione politica di imprimere una forte accelerazione nella produzione, insieme alle caratteristiche di stabilità e di conservazione delle proteine a temperature compatibile con i frigoriferi “ordinari”, aprono finalmente concrete speranze che i vaccini possano essere distribuiti in parti del mondo che finora non sono state raggiunte.
Può Novavax bloccare Omicron?
Prima di concludere, val la pena sottolineare che i dati disponibili ad oggi indicano cheNuvaxovid è efficace contro la variante delta, come gli altri vaccini più utilizzati – Pfizer/BioNTech, Moderna, Astra Zeneca. Attualmente è ancora presto per avere dati estesi sulla protezione rispetto ad omicron, ma i dati preliminari, rilasciati in una conferenza stampa il 22 dicembre scorso, indicano che gli anticorpi indotti riconoscono omicron in modo efficace. Tuttavia, anche Novavax, come Pfizer e Moderna, ha annunciato il progetto di ottimizzare il vaccino per adattarlo ad omicron, inserendo mutazioni specifiche di omicron nella sequenza della Spike da esprimere nelle cellule di falena come descritto sopra. I primi passaggi sono previsti in gennaio 2022.
In sintesi
Il vaccino prodotto dalla Novavax potrebbe cambiare la diffusione delle campagne vaccinali nel mondo:
- è un vaccino proteico che non usa DNA né RNA, e rientra quindi in una tradizione, ormai lunga di un secolo, di dimostrata efficacia e tollerabilità,
- ha bassi costi di produzione,
- può essere conservato e distribuito in normali frigoriferi,
- verrà prodotto dal Serum Institute of India in alcuni miliardi di dosi che potranno essere distribuite anche in paesi che finora non hanno avuto accesso, sotto l’egida di Covax e dell’OMS.
Possiamo, quindi, sperare che questo vaccino aiuti ad imprimere una vera svolta alla lotta alla pandemia.
[1] L’autorizzazione condizionale all’immissione in commercio viene concessa in assenza del numero di dati clinici richiesti dalla procedura di approvazione completa ma in presenza di un alto rapporto tra benefici e rischi